原电池是利用两个电极的电势不同,产生电势差,从而使电子流动产生电流,是一种将化学能转化成电能的装置。由于各种型号的原电池氧化还原反应的可逆性很差,放完电后,不能重复使用,故又称为一次电池。
现以铜锌电池为例,说明原电池产生电能的机理。这种电池如图12-1所示,是由一个插入CuSO4溶液中的铜电极组成的“半电池”和另一个插入ZnSO4溶液中的锌电极组成的半电池所组成。两个半电池以一个倒置的U形管连接起来,管中装满用饱和KCl溶液和琼脂作成的凝胶,称为“盐桥”。这时,如果用导线将两极连接,并且中间串联一个电流计,那本,电流计指针将发生偏转,说明线路上有电流通过。同时可以观察到锌片开始溶解而铜片上有铜沉积上去。
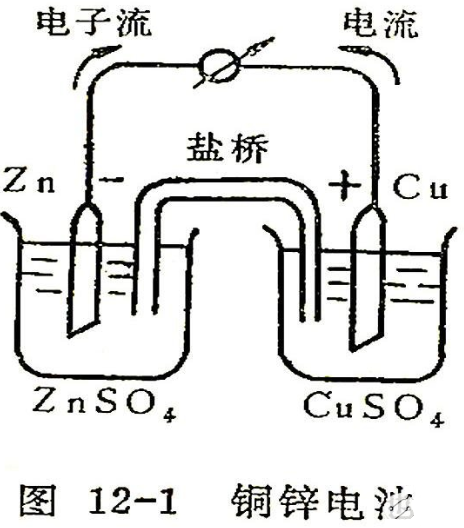
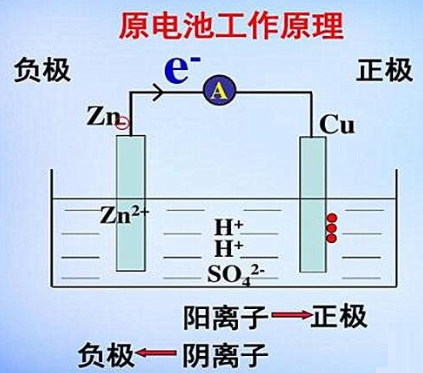
我们从观察到的实验现象进一步探讨这种装置产生电流的原因。根据金属置换次序可知,锌比铜活泼,锌容易失去两个电子氧化变成Zn2+进入溶液 Zn ⇋Zn2++2e,把电子留在锌极上,使锌极带负电荷,称为“负极”。若用导线把锌极和铜极连接起来,此时,电子从锌极经过导线流向铜极,在铜极周围的Cu2+从铜极上获得电子还原成金属铜,Cu2++2e ⇋Cu,沉积在铜极上,铜极称为“正极”。为了保持两杯溶液的电中性,这时盐桥开始起导通电池内部电路的作用,Cl-离子从盐桥中扩散到左边溶液中去,与锌极溶解下来的Zn2+的正电荷相平衡,K+从盐桥中扩散到右边溶液中去,与由于Cu2+沉积为金属铜而留下的SO42-离子的负电荷相平衡。这样就能使锌的溶解和铜的析出继续进行,电流得以继续流通。所以,流经整个体系的电流是由金属导体中的自由电子和溶液中离子的迁移以及电极和溶液界面上伴随发生的氧化、还原反应而进行的。
电池常用符号表示。上述铜锌电池可以表示如下:
Zn|ZnSO4(1M)||CuSO4(1M)|Cu
习惯上规定把负极和有关的溶液体系(注明浓度)写在左边,正极和有关的溶液体系(注明浓度)写在右边。也就是规定左边的电极进行氧化反应,右边的电极进行还原反应。
单线“|”表示锌电极和硫酸锌溶液这两个相的界面,铜电极和硫酸铜溶液这两个相的界面,盐桥通常用双线“||”表示,因为盐桥存在两个接界面,即硫酸锌溶液与盐桥之间界面和盐桥与硫酸铜溶液之间界面。
任何一个自发的氧化还原反应,在原则上都可以设计成电池(气体不能直接作为电极,必须附以不活泼的金属(如铂),书写气体电极时必须注明气体压力,如氢电极书写为:
PtH2(1大气压)|H+(0.1M)
重要的条件之一就是要使氧化与还原反应分开在两个电极上进行。否则,如若将锌片直接接触CuSO4溶液,则锌片与Cu2+直接发生氧化还原反应,Zn+Cu2+=Cu+Zn2+,此时,化学能不能转变为电能,而是以热的形式释放出来。
